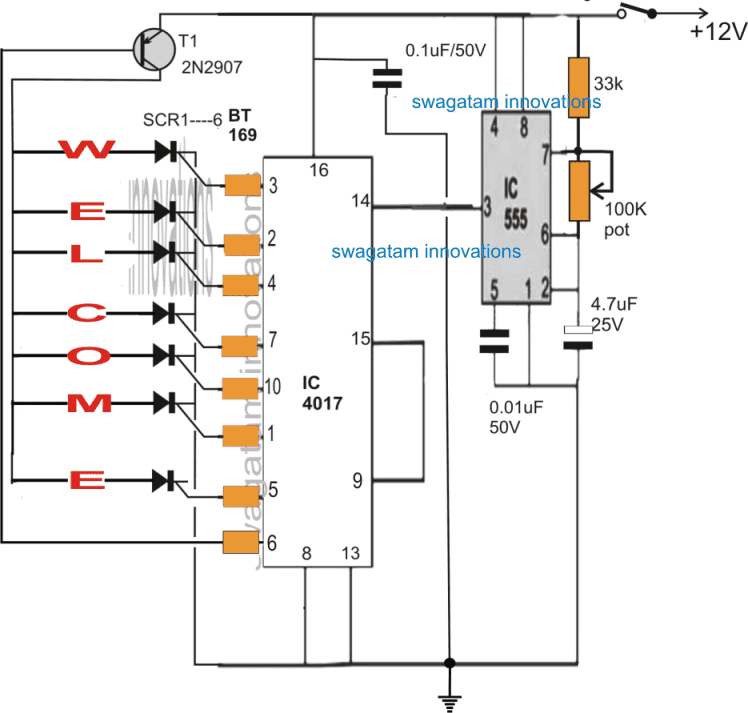
Molekylearrangementet i faste stoffer, væsker , og gasser er ikke det samme. I faste stoffer er de ordnet tett slik at elektronene i molekylatomer beveger seg inn i naboatomene. I gasser er molekylarrangementet ikke i nærheten, mens det i væsker er moderat. Derfor dekker elektronbanen delvis når atomene nærmer seg gjensidig. På grunn av kombinasjonen av atomer i faste stoffer, som et alternativ til enkelt energinivåer, dannes nivåene av energibånd. Settet med energinivåer er tettpakket, som er kjent som et energibånd.
Hva er Energy Band?
Definisjonen av energibånd er antall atomer innenfor en krystallstein kan være nærmere hverandre, i tillegg til at et antall elektroner vil samhandle med hverandre. Energinivået til elektroner i skallet kan forårsakes på grunn av endringene i energinivået. Hovedtrekket til energien bånd er at elektronens energitilstander for elektronikk er stabile i forskjellige områder. Så, energinivået til et atom vil endre seg i ledningsbånd og valensbånd.
Energy Band Theory
I henhold til teorien om Bohr inkluderer hvert skall fra et atom en separat mengde energi på forskjellige nivåer. Denne teorien gir hovedsakelig detaljer om kommunikasjon av elektroner blant innvendig skall og utvendig skall. I henhold til teorien om energibånd er energibåndene klassifisert i tre typer som inkluderer følgende.

energi-bånd-teori
- Valence band
- Forbudt energigap
- Ledningsbånd
Valance Band
Strømmen av elektroner i atomene i faste energinivåer, men elektronens energi i det indre skallet er bedre enn det ytre skallet av elektroner. Elektronene som er tilstede i det ytre skallet kalles valanseelektroner.
Disse elektronene inkluderer en sekvens av energinivåer som danner et energibånd kalt valensbånd. Dette båndet inkluderer maksimal opptatt energi.
Ledningsbånd
Valenselektronene er løst festet mot kjernen ved romtemperatur. Noen av elektronene fra valenselektroner vil forlate båndet fritt. Så disse kalles frie elektroner fordi de flyter mot naboatomene.
Disse frie elektronene vil lede strømmen i en leder som er kjent som ledningselektroner. Båndet som inkluderer elektroner er navngitt som ledningsbånd og den okkuperte energien til dette vil være mindre.
Forbidden Gap
Det forbudte gapet er gapet mellom ledningsbåndet og valensbåndet. Dette bandet er forbudt uten energi. Derfor er det ingen elektronstrøm i dette båndet. Strømmen av elektroner fra valensen til ledningen vil passere gjennom dette gapet.
Hvis dette gapet er større, er elektronene i valensbåndet sterkt bundet mot kjernen. For øyeblikket, for å drive elektronene ut fra dette båndet, er det nødvendig med en liten ytre kraft, som tilsvarer det forbudte energigapet. I det følgende diagrammet er de to båndene, samt et forbudt gap illustrert nedenfor. Basert på gapet størrelse, halvledere , ledere og isolatorer dannes.
Typer energiband
Energibåndene er klassifisert i tre typer, nemlig
- Isolatorer
- Halvledere
- Dirigenter
Isolatorer
De beste eksemplene på en isolator er tre og glass. Disse isolatorene tillater ikke strøm av strøm å strømme gjennom dem. Isolatorene har ekstremt lav ledningsevne og høy motstand. I isolatoren er energigapet ekstremt høyt, det vil si 7eV. Materialet kan ikke utføre på grunn av elektronstrømmen fra båndene slik at valens til ledningen er umulig.

energi-bånd-i-isolatorer
De viktigste egenskapene til isolatorer inkluderer hovedsakelig energigapet som forbudt er ekstremt stort. For noen typer isolatorer, når temperaturen stiger, kan de illustrere en viss overføring.
Halvledere
De beste eksemplene på halvledere er silisium (Si) og Germanium (Ge) som er de mest brukte materialene. De elektriske egenskapene til disse materialene ligger blant halvledere så vel som isolatorer. Følgende bilder viser halvlederens energibånddiagram hvor ledningsbåndet kan være ledig og valensbåndet er helt fylt, men det forbudte gapet mellom disse båndene er minutt som er 1 eV. Det forbudte gapet til Ge er 0.72eV og Si er 1.1eV. Derfor trenger halvleder lite ledningsevne.

energi-bånd-i-halvledere
De viktigste egenskapene til halvledere inkluderer hovedsakelig energigapet som forbudt er ekstremt lite. Når temperaturen på halvlederen øker, vil konduktiviteten reduseres.
Dirigenter
Lederen er en type materiale der det forbudte energigapet forsvinner som valensbåndet samt ledningsbåndet blir ekstremt nært som de delvis dekker. De beste eksemplene på ledere er gull, aluminium, kobber og gull. Fri elektroners tilgjengelighet ved romtemperatur er enorm. Energibånddiagrammet til lederen er vist nedenfor.

energi-bånd-i-ledere
Hovedegenskapene til ledere inkluderer hovedsakelig energigapet som forbudt ikke vil eksistere. Energibåndene som valance så vel som ledning vil bli overlappende. Tilgjengeligheten av ledige elektroner for ledning er god. Ledningen vil øke når det lille antallet spenninger øker.
Dermed handler alt om en oversikt over energibåndet . Av informasjonen ovenfor kan vi til slutt konkludere med at molekylets arrangement i stoffene som faste stoffer, væsker og gasser er ulikt. I gasser er molekylene ikke tette, i faste stoffer er molekylene ordnet veldig tett og i væsker er molekylene arrangert i moderat. Så elektronene i molekylets atomer har en tendens til å strømme inn i orbitalene på tilstøtende atomer. Derfor dekker elektronbanen delvis mens atomene nærmer seg i fellesskap. På grunn av blanding av atomer i faste stoffer, som en erstatning for bare energinivåer, vil energibåndene bli dannet. Disse er tettpakket og det kalles energibånd. Her er et spørsmål til deg, energibånd i faste stoffer?